महत्वपूर्ण तथ्य—
1.वर्ग 1 के तत्त्व क्षार धातु कहलाते हैं।
2. वर्ग 2 के तत्त्व क्षारीय मृदा धातु कहलाते हैं।
3. वर्ग 17 के तत्त्व हैलोजन्स कहलाते हैं।
4. आधुनिक आवर्त सारणी के जनक मोसले को कहा जाता है।
5. सर्वप्रथम आवर्त सारणी मेंडलीव ने बनाया था। इसलिए मेंडलीव को आवर्त सारणी का जनक कहा जाता है।
6. आवर्त सारणी में दाएँ से बाएँ क्षैतिज भाग को आवर्त कहते हैं तथा आवर्त सारणी में ऊपर-नीचे उर्ध्वाधर रेखा के बने भाग को वर्ग कहते हैं।
7. वायुयान के टायर और गोताखोर के सीलेंडर में हीलियम गैस भरा जाता है।
8. चमकिले प्रकाश के लिए नियॉन का प्रयोग किया जाता है। जैसे- टेस्टर
9. बंद पैकेटों में नाइट्रोजन गैस भरा जाता है।
10. आवर्त सारणी में बाएँ से दाएँ जाने पर परमाणु आकार घटता है, तथा ऊपर से नीचे आने पर बढ़ता है।
11. आवर्त सारणी में बाएँ से दाएँ जाने पर धातुई गुण घटता है, तथा ऊपर से नीचे आने पर बढ़ता है।
12. न्यूलैंड्स के अष्टक सिद्धांत की मुख्य कमी यह थी कि यह केवल हल्के तत्त्वों के लिए ही ठीक से लागू हो पाया। भारी तत्वों के संबंध में यह सही नहीं उतरा।
13. किसी कोश (कक्षा) में इलेक्ट्रॉनों की अधिकतम संख्या 2n2 होती है।
14. आधुनिक आवर्त सारणी के क्षैतिज कतारों को आवर्त कहा जाता है। जबकि उदग्र कतारों को समूह कहते हैं।
15. आवर्त सारणी में बाएँ से दाएँ जाने पर अधातुई गुण बढ़ता है, तथा ऊपर से नीचे आने पर घटता है।
16. आधुनिक आवर्त सारणी में तत्वों के गुणधर्म उनके परमाणु संख्या के आवर्त फलन होते हैं।
* तत्त्वों के आवर्ती वर्गीकरण की आवश्यकता क्यों ?
प्रारंभ में जब बहुत ही कम तत्त्व ज्ञात थे तब उनके गुणों का अलग-अलग अध्ययन करने में कोई विशेष कठिनाई नहीं होती थी। किंतु जब एक-एक करके बहुत-से तत्त्वों का आविष्कार हुआ तो उनके गुणों का अलग-अलग अध्ययन करने में कठिनाई महसुस होने लगी। अब तक 111 तत्त्वों का आविष्कार हो चुका है।
तत्त्वों के वर्गीकरण के लाभ-
तत्त्वों के वर्गीकरण से निम्नलिखित लाभ प्राप्त होते हैं-
1. इसमें तत्त्वों के गुणों का अध्ययन नियमित तरीके से किया जा सकता है।
2. सभी तत्त्वों के गुणों का अलग-अलग अध्ययन करने की आवश्यकता नहीं पड़ती है। किसी समुह के एक विशिष्ट तत्त्व के गुणों की जानकारी हो जाने पर उस समुह के अन्य तत्त्वों के गुणों का अनुमान लगाया जा सकता है।
3. किसी समूह के तत्त्वों के गुणों में होने वाले क्रमिक परिवर्तन को समझना आसान हो जाता है।
4. इससे विभिन्न समुहों के तत्त्वों के पारस्परिक संबंध की जानकारी प्राप्त की जा सकती है।
डोबरेनर के त्रियक-
19वीं शताब्दी के प्रारंभ में जर्मन रसायनज्ञ जॉन डोबरेनर ने रासायनिक दृष्टि से सदृश तत्त्वों को तीन-तीन समूहों में वर्गीकृत किया। ये समुह त्रियक कहलाते हैं। इन्होंने त्रियक के नियम की घोषणा की।
त्रियक नियम के अनुसार-
त्रियक के तत्त्वों को उनके परमाणु द्रव्यमानों के क्रम में सजाने पर मध्यवर्ती तत्त्व का परमाणु द्रव्यमान किनारे वाले शेष दोनों तत्त्वों के परमाणु द्रव्यमानों का औसत होता है।
इसे ‘डोबरेनर का त्रियक’ भी कहते हैं।
न्यूलैंड्स का अष्टक नियम- यदि तत्त्वों को उनके बढ़ते हुए परमाणु द्रव्यमानों के क्रम में सजाया जाए तो किसी भी तत्त्व से प्रारंभ करने पर आठवें तत्त्व के गुण पहले तत्त्व के गुणों के समान होते हैं, जैसा कि संगीत का आठवाँ स्वर पहले स्वर के समान होता है।
अष्टक के दोष-
1. न्यूलैंड्स का अष्टक नियम हल्के तत्त्वों (कैल्सियम तक) के लिए ही लागु होता है, भारी तत्त्वों के लिए नहीं, क्योंकि कैल्सियम के बाद प्रत्येक आठवें तत्त्व के गुण प्रथम तत्त्व के गुण से भिन्न होते हैं।
2. न्यूलैंड्स का अनुमान था कि प्रकृति में सिर्फ 56 तत्त्व ही हैं और आगे चलकर अन्य तत्त्वों का आविष्कार नहीं होगा। किंतु, यह अनुमान गलत निकला। आगे चलकर अन्य बहुत-से नए तत्त्वों के आविष्कार हुए जिनके आचरण अष्टक नियम के प्रतिकुल थे।
3. अक्रिय गैसों का आविष्कार हो जाने पर नवम् तत्त्व प्रथम तत्त्व के समान गुण वाला होता है, न कि आठवाँ।
मेंडलीव का आवर्त नियम-
न्यूलैंड्स के अष्टक नियम से प्रेरित होकर 1869 में रूसी रसायनज्ञ दमित्री मेंडलीव ने तत्त्वों के भौतिक और रासायनिक गुणों का गहन अध्ययन करके तत्त्वों के वर्गीकरण की एक नई प्रणाली विकसित की। तत्त्वों के उनके बढ़ते हुए परमाणु द्रव्यमानों के क्रम में सजाकर उन्होंने देखा कि
1. तत्त्वों के गुणों में क्रमिक परिवर्तन होता है,
2. तत्त्वों के एक निश्चित संख्या के बाद लगभग समान गुणवाले तत्त्व पाए जाते हैं।
अपने निष्कर्षों के आधार पर मेंडलीव ने एक नियम का प्रतिपादन किया जिसे मेंडलीव का आवर्त नियम कहते हैं।
मेंडलीव के आवर्त नियम के अनुसार-
तत्त्वों के भौतिक व रासायनिक गुण उनके परमाणु द्रव्यमानों के आवर्तफलन होते हैं, दूसरे शब्दों में यदि तत्त्वों को उनके बढ़ते हुए परमाणु द्रव्यमानों के क्रम में सजाया जाए तो एक निश्चित संख्या के बाद समान गुणवाले तत्त्व पाए जाते हैं।
मेंडलीव की आवर्त सारणी की मुख्य विशेषताएँ-
1. वर्ग और उपवर्ग
आवर्त सारणी की उदग्र स्तंभों को वर्ग कहते हैं। इन्हें रोमण अंकों द्वारा निरूपित किया गया है। प्रत्येक वर्ग को A और B , दो उपवर्गों में बाँटा गया है। वर्गों की कुल संख्या 9 होती है।
2. आवर्त
आवर्त सारणी की क्षैतिज कतारें आवर्त कहलाती हैं। सारणी में 1 से लेकर 7 तक कुल सात आवर्त हैं।
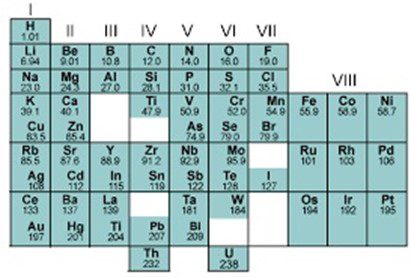
मेंडलीव के आवर्तन सारणी की विशेषताएँ—
1. इस आवर्त सारणी से तत्त्वों का अध्ययन करना काफी आसान हो गया।
2. मेंडलीव के आवर्त सारणी में कुल 63 तत्व थे। भविष्य में नए तत्त्वों की खोज के लिए मेंडलीव सारणी में रिक्त स्थान रख छोड़ा था। उन्होंने नए तत्त्वों की रासायनिक संरचना के बारे में भी भविष्यवाणी की थी।
3. मेंडलीव के कुछ तत्त्व के परमाणु द्रव्यमान गलत निकाले गए थे, जिसे आगे चलकर सुधारा गया।
मेंडलीव के आवर्त सारणी के दोष-
1. मेंडलीव के आवर्त सारणी में हाइड्रोजन के स्थान का निर्धारण नहीं किया गया था।
2. मेंडलीव के आवर्त सारणी परमाणु द्रव्यमानों के क्रम में सजाया गया था, लेकिन कुछ तत्त्व इस पद्धति का पालन नहीं किया है। जैसे- आर्गन (40) को पोटैशियम (39) से पहले रखा गया है।
3. आठवें वर्ग में तीन-तीन तत्त्व को एक ही स्थान में रखा गया है।
4. समान गुणों वाले तत्वों को अलग-अलग जबकि असमान गुणों वाले तत्वों को एक साथ रखा गया है।
5. मेंडलीव के आवर्त सारणी में समस्थानिकों के लिए कोई व्यवस्था नहीं थी।
मोसले का आवर्त नियम-
*तत्त्वों के भौतिक एवं रासायनिक गुण उनकी परमाणु संख्याओं के आवर्तफलन होते हैं।
* मोसले ने आधुनिक आवर्त सारणी का निमार्ण परमाणु द्रव्यमान पर नहीं, बल्कि परमाणु संख्याओं के आधार पर किया।
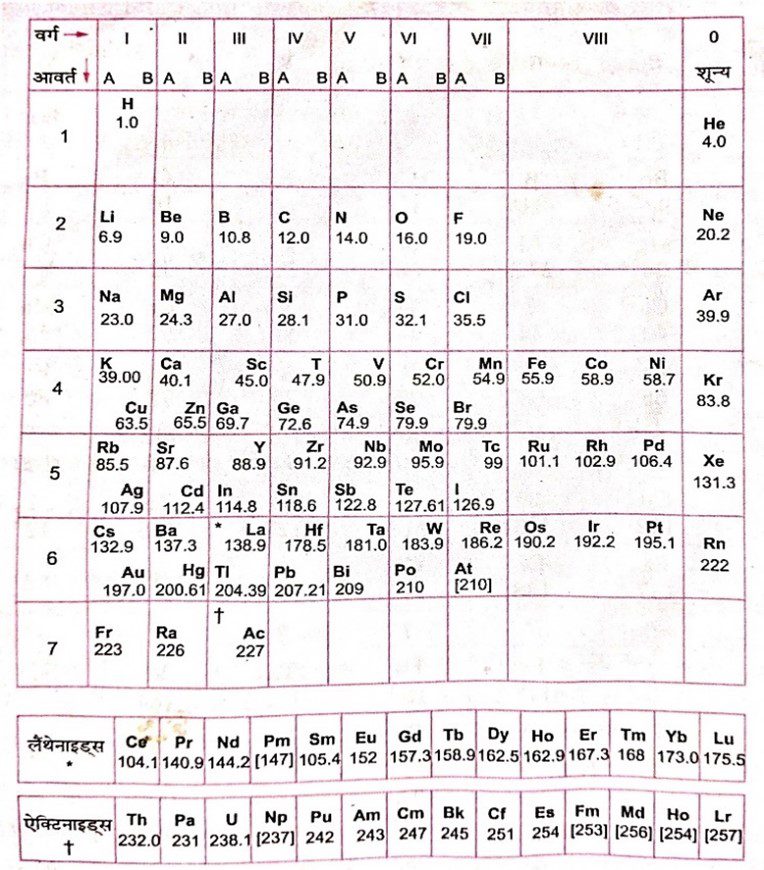
*परमाणु संख्या के आधार पर तत्त्वों को सजाकर आवर्त सारणी को संशोधित रूप में प्रस्तुत किया जिसे आधुनिक आवर्त सारणी कहते हैं। इसे आवर्त सारणी का दीर्घ या वृहद रूप भी कहते हैं।
आधुनिक आवर्त सारणी का विवरण :-
1. आधुनिक आवर्त सारणी में तत्त्वों को उनकी बढ़ती हुई परमाणु संख्या के क्रम में सजाया गया है।
2. इसमें कुल सात आवर्त हैं।
3. आधुनिक आवर्त सारणी में लैंथेनाइड्स एवं ऐक्टिनाइड्स को छोड़कर 18 उदग्र स्तंभ है। ये 1, 2, 3, 4, ….., 18 संख्याओं द्वारा व्यक्त किए गए हैं।
4. इस आवर्त सारणी के नीचे दो कतारों में लैथेंनाइड्स और ऐक्टिनाइड्स हैं। ये वर्ग 3 के सदस्य हैं।
लैंथेनाइड्स : La (57), Ce (58) – Lu (71)
ऐक्टिनाइड्स : Ac (89), Th (90) – Lr (103)
इस आवर्त सारणी को चार ब्लॉकों में बाँट दिया गया है। ये चार ब्लॉक हैं- s, p, d और f
आवर्त सारणी की विशेषताएँ-
1. इलेक्ट्रॉनिक विन्यास-किसी वर्ग-विशेष के सभी तत्त्वों के बाह्य इलेक्ट्रॉनिक विन्यास समान होते हैं, अर्थात सभी तत्त्वों के परमाणुओं में संयोजी इलेक्ट्रॉनों की संख्या समान होती है।
2. संयोजकता-किसी वर्ग के सभी तत्त्वों की संयोजकता समान होती है।
3. परमाणु का आकार या त्रिज्या-आवर्त सारणी के किसी वर्ग में ऊपर से नीचे आने पर परमाणु का आकार बढ़ता जाता है।
4. धातुई गुण-किसी वर्ग में ऊपर से नीचे आने पर तत्त्व का धातुई गुण बढ़ने लगता है।
5. भौतिक गुण-किसी वर्ग में ऊपर से नीचे आने पर धातुई तत्त्वों के भौतिक गुण (द्रवनांक, क्वथनांक आदि) क्रमशः घटते जाते हैं, किंतु घनत्व में बढ़ने की प्रवृति होती है।
वर्ग में ऊपर से नीचे आने पर अधातुओं के भौतिक गुण क्रमशः बढ़ते जाते हैं।
6. आधुनिक आवर्त सारणी के दोष-आधुनिक आवर्त सारणी में मेंडलीव की आवर्त सारणी के अधिकांश दोष दूर कर दिए गए हैं, फिर भी इसमें निम्नलिखित दोष रह गए हैं-
7. हाइड्रोजन का स्थान-इस आवर्त सारणी में भी मेंडलीव की सारणी की भाँति हाइड्रोजन का स्थान अनिर्णित है।
8. हीलियम का स्थान-इलेक्ट्रॉनिक विन्यास के अनुसार हीलियम का स्थान वर्ग 2 में क्षारीय मृदा धातुओं के साथ होना चाहिए था, किंतु इसे उत्कृष्ट गैसों के साथ वर्ग 18 में रख दिया गया है।
*आवर्त सारणी के वर्ग 0 या वर्ग 18 वाले तत्त्व गैस है जिन्हें उत्कृष्ट गैसें कहते हैं। ये सभी तत्त्व रासायनिक दृष्टि से अक्रिय होते हैं।
वस्तुनिष्ठ प्रश्न
1.आवर्त सारणी के उदग्र स्तम्भों को क्या कहा जाता है ?
[ A ] वर्ग
[ B ] आवर्त
[ C ] अपररूप
[ D ] कोई नहीं
Ans ⇒ (A)
2 .आवर्त सारणी के प्रथम वर्ग के सदस्य है –
[ A ] अम्लीय धातु
[ B ] क्षारीय धातु
[ C ] अक्रिय गैस
[ D ] मिश्रधातु
Ans ⇒ (B)
3.आवर्त सारणी में शून्य समूह का तत्त्व है :
[ A ] H
[ B ] He
[ C ] CO2
[ D ] Cl2
Ans ⇒ (B)
4 . मिथेन में कितने सह-संयोजक बंधन होते हैं ?
[ A ] 2
[ B ] 4
[ C ] 6
[ D ] 8
Ans ⇒ (B)
5. आधुनिक आवर्त सारणी में तत्त्वों के वर्गीकरण का आधार है :
[ A ] परमाणु आयतन
[ B ] परमाणु घनत्व
[ C ] परमाणु द्रव्यमान
[ D ] परमाणु संख्या
Ans ⇒ (D)
6. अमोनिया के अणु में नाइट्रोजन एवं हाइड्रोजन के परमाणुओं की संख्या का अनुपात है :
[ A ] 2 : 1
[ B ] 1 : 2
[ C ] 1: 3
[ D ] 3 : 1
Ans ⇒ (C)
7. लोहे की परमाणु संख्या है :
[ A ] 23
[ B ] 26
[ C ] 25
[ D ] 24
Ans ⇒ (B)
8. आधुनिक आवर्त सारणी में वर्गों की संख्या (ऊर्ध्व स्तंभ या समूह की संख्या) होती है :
[ A ] 9
[ B ] 18
[ C ] 11
[ D ] 10
Ans ⇒ (B)
9. ओजोन के एक अणु में ऑक्सीजन के परमाणुओं की संख्या होती है ?
[ A ] 1
[ B ] 2
[ C ] 3
[ D ] 4
Ans ⇒ (C)
10. आवर्त सारणी में कितने आवर्त (क्षैतिज पंक्तियाँ) होते हैं ?
[ A ] 5
[ B ] 6
[ C ] 7
[ D ] 4
Ans ⇒ (C)
11. हीलियम कैसा तत्त्व है ?
[ A ] अक्रिय
[ B ] क्रियाशील
[ C ] सक्रिय
[ D ] उदासीन
Ans ⇒ (A)
12. आवर्त सारणी में कितने आवर्त हैं ?
[ A ] सात
[ B ] नौ
[ C ] आठ
[ D ] बारह
Ans ⇒ (A)
13. त्रिक का नियम निम्नलिखित में से किसके द्वारा प्रतिपादित किया गया ?
[ A ] न्यूलैंड्स द्वारा
[ B ] डॉबेराइनर द्वारा
[ C ] मेन्डलीफ द्वारा
[ D ] मोज्ले द्वारा
Ans ⇒ (B)
14. अष्टक का नियम निम्नलिखित में से किसके द्वारा प्रस्तुत किया गया ?
[ A ] लोथर मेयर द्वारा
[ B ] मेन्डलीफ द्वारा
[ C ] डॉबेराइनर द्वारा
[ D ] न्यूलैंड्स द्वारा
Ans ⇒ (C)
15. मेन्डलीफ के आवर्ती नियम के अनुसार तत्वों के गुणधर्म इनमें से किनका आवर्ती फलन होता है ?
[ A ] परमाणु संख्या
[ B ] परमाणु द्रव्यमान
[ C ] परमाणु आयतन
[ D ] परमाण्विक आकार
Ans ⇒ (B)
16. मेन्डलीफ ने तत्त्वों को किसके बढ़ते क्रम में वर्गीकृत किया ?
[ A ] परमाणु संख्या
[ B ] रासायनिक अभिक्रियाशीलता
[ C ] परमाणु द्रव्यमान
[ D ] संयोजकता
Ans ⇒ (C)
17. आवर्त सारणी के किसी समूह विशेष में तत्वों के विद्युत धनात्मक अभिलक्षण ऊपर से नीचे की ओर आने पर –
[ A ] बढ़ता है
[ B ] घटता है
[ C ] नियत रहता है
[ D ] अनियमित तरीके से परिवर्तित होता है
Ans ⇒ (A)
18. आवर्त सारणी के किसी आवर्त में बाएँ से दाएँ जाने पर तत्त्वों के ऑक्साइड की अम्लीय प्रकृति :
[ A ] घटती जाती है
[ B ] बढ़ती जाती है
[ C ] अपरिवर्तित रहती है
[ D ] अनियमित तरीके से बदलती है
Ans ⇒ (B)
19. निम्नलिखित में से सबसे अधिक अभिक्रियाशील हैलोजन कौन है ?
[ A ] फ्लोरीन
[ B ] क्लोरीन
[ C ] ब्रोमीन
[ D ] आयोडीन
Ans ⇒ (A)
20. निम्नलिखित में से कौन सबसे अधिक क्षारकीय होगा ? ।
[ A ] Na 2O
[ B ] Al 2O 3
[ C ] SO2
[ D ] NO 2
Ans ⇒ (A)
21. आवर्त सारणी के समूह I के तत्व कहलाते हैं :
[ A ] सामान्य तत्त्व
[ B ] संक्रमण तत्त्व
[ C ] क्षार धातु
[ D ] लेन्थेनाइड्स
Ans ⇒ (C)
22. मैग्नीशियम आवर्त सारणी के किस समूह का सदस्य है ?
[ A ] समूह I
[ B ] समूह II
[ C ] अधातु तत्वों का
[ D ] समूह VIII
Ans ⇒ (B)
23. तत्वों के निम्नलिखित जोड़ों में किनके रासायनिक आचरण (chemical behaviour) समान होंगे ?
[ A ] सोडियम एवं ऐल्युमिनियम
[ B ] आर्गन एवं पोटैशियम .
[ C ] बोरॉन एवं जर्मेनियम
[ D ] नाइट्रोजन एवं फास्फोरस
Ans ⇒ (D)
24. निम्नलिखित तत्वों में से किसकी संभावना है कि यह अधात्विक अभिलक्षण को प्रदर्शित कर सकता है :
[ A ] As
[ B ] Be
[ C ] B
[ D ] Br
Ans ⇒ (D)
25. आधुनिक आवर्त सारणी का दीर्घतम रूप किसकी प्रस्तुतीकरण है ?
[ A ] मेन्डलीफ
[ B ] मोज्ले
[ C ] लोथर मेयर
[ D ] लुइस पाश्चर
Ans ⇒ (B)
26. निम्नलिखित तत्त्वों में से कौन सबसे अधिक अधात्विक गुणधर्म को प्रदर्शित करता है ?
[ A ] ब्रोमीन
[ B ] क्लोरीन
[ C ] फास्फोरस
[ D ] सल्फर
Ans ⇒ (B)
27. किसने कहा कि तत्त्वों के मूल गुणधर्म उनके परमाणु संख्याएँ हैं न की परमाणु द्रव्यमान ?
[ A ] लोथर मेयर
[ B ] मोज्ले
[ C ] मेन्डलीफ
[ D ] बोर
Ans ⇒ (B)
28. आधुनिक आवर्त्त नियम के अनुसार, तत्त्वों का गुण धर्म :-
[ A ] परमाणु द्रव्यमान का आवर्त फलन है
[ B ] परमाणु संख्या का आवर्त फलन है
[ C ] परमाणु साइज का आवर्त फलन है।
[ D ] परमाणु आयतन का आवर्त फलन है
Ans ⇒ (B)
29. आधुनिक आवर्त सारणी में बाईं से दाईं ओर जाने पर परमाणु साइज (आकार) : –
[ A ] बढ़ता है
[ B ] घटता है
[ C ] अपरिवर्तित रहता है
[ D ] इनमें से कोई नहीं
Ans ⇒ (A)
30. वुल्फगांग डॉबेराइनर किस देश से संबंधित है ?
[ A ] फ्रांस
[ B ] जर्मनी
[ C ] अमेरिका
[ D ] ऑस्ट्रेलिया
Ans ⇒ (B)
31. मेन्डेलीफ का जन्म कब हुआ था ?
[ A ] 1834 ई०
[ B ] 1835 ई०
[ C ] 1836 ई.
[ D ] 1837 ई.
Ans ⇒ (A)
32. भारतीय संगीत प्रणाली में संगीत के कितने सूर होते है ?
[ A ] 5.
[ B ] 6
[ C ] 7
[ D ] 8
Ans ⇒ (C)
33. जब मेन्डेलीफ ने अपना कार्य आरंम्भ किया तब तक कितने तत्त्व ज्ञात थे ?
[ A ] 60
[ B ] 61
[ C ] 62
[ D ] 63
Ans ⇒ (D)
34. आधुनिक आवर्त सारणी में परमाणु साइज से क्या पता चलता है ?
[ A ] परमाणु की व्यास
[ B ] परमाणु की त्रिज्या
[ C ] परमाणु की परिधि
[ D ] इनमें से कोई नहीं
Ans ⇒ (B)
35. 1 pm (पीकोमीटर) कितने मीटर के बराबर होता है ?
[ A ] 10 -10 m
[ B ] 10 -11 m
[ C ] 10 -12 m
[ D ] 10 -13 m
Ans ⇒ (C)
36. किसी भी तत्त्व की संयोजकता कैसे निर्धारित की जाती है ?
[ A ] इलेक्ट्रॉन की संख्या से
[ B ] प्रोट्रॉन की संख्या से
[ C ] न्यूट्रॉन की संख्या से
[ D ] इनमें सभी से
Ans ⇒ (A)
अति लघु उत्तरीय प्रश्न
1. न्यूलैंड के अष्टक सिद्धांत की क्या सीमाएँ हैं ?
उत्तर⇒ न्यूलैंड के अष्टक सिद्धांत की सीमाएँ हैं.
(i) अष्टक का सिद्धांत केवल कैल्सियम तक ही लागू होता था, क्योंकि कैल्सियम के बाद प्रत्येक आठवें तत्त्व का गुणधर्म पहले तत्त्व से नहीं मिलता।
(ii) बाद में कई नये तत्त्व पाए गये जिनके गुणधर्म अष्टक सिद्धांत से मेल नहीं खाते थे।
(ii) अपनी सारणी में इन तत्त्वों को समंजित करने के लिए न्यूलैंड ने दो तत्त्वों को एक साथ रख दिया और कुछ असमान तत्त्वों को एक स्थान में रख दिया।
उदाहरण- कोबाल्ट तथा निकेल एक साथ हैं तथा इन्हें एक साथ उसी स्तम्भ में रखा गया है जिसमें फ्लुओरीन, क्लोरीन एवं ब्रोमीन हैं यद्यपि इनके गुणधर्म उन दोनों तत्त्वों से भिन्न हैं। आयरन को कोबाल्ट एवं निकेल से दूर रखा गया है जबकि उनके गुणधर्मों में समानता होती है।
2. तत्त्वों के आवर्त वर्गीकरण के लिए परमाणु द्रव्यमान संख्या की अपेक्षा परमाणु संख्या को उत्तम आधार क्यों माना गया है ?
उत्तर⇒ तत्त्व का परमाणु द्रव्यमान नाभिक के कारण है। नाभिक तत्त्व के केन्द्र में स्थित है। इसमें प्रोटॉन और न्यूट्रॉन हैं, जिनका पुंज होता है। तत्त्व का नाभिक गुणों की व्याख्या नहीं करता। वास्तव में तत्त्वों के गुण इलेक्ट्रॉनिक वितरण से संबंधित हैं। ज्यों-ज्यों परमाणु संख्या बदलती है वैसे-वैसे इलेक्ट्रॉनिक वितरण भी बदलता जाता है। इसलिए परमाणु तत्त्वों के वर्गीकरण का उत्तम आधार है।
3. नाइट्रोजन (परमाणु संख्या 7) तथा फॉस्फोरस (परमाणु संख्या 15) आवर्त सारणी के समूह 15 के तत्त्व है। इन दोनों तत्त्वों का इलेक्ट्रॉनिक विन्यास लिखिए। इनमें से कौन-सा तत्त्व अधिक ऋण विद्युत होगा और क्यों ?
उत्तर⇒ N (Z = 7) 2,5
P (Z = 15) 2,8,5
N अधिक वैद्युत ऋणात्मक होगा, क्योंकि इसका परमाण्वीय आकार अपेक्षाकृत कम होता है। किसी वर्ग में जब शीर्ष से तल (आधार) की ओर बढ़ते हैं, प्रत्येक स्तर पर परमाणुओं में इलेक्ट्रॉनों का एक कोश बढ़ता जाता है। इस प्रकार परमाणुओं में इलेक्ट्रॉन कोशों की संख्या धीरे-धीरे बढ़ती जाती है जिसके कारण परमाणुओं का आकार भी बढ़ता है। परमाणु के आकार में इस वृद्धि के कारण, उसका नाभिक परमाणु में और अन्दर चला जाता है। आने वाले इलेक्ट्रॉन के लिए नाभिक K का आकर्षण कम हो जाता है, जिसके कारण परमाणु आसानी से ऋणायान नहीं बना सकता है और ऋण विद्युत लक्षण कम होता जाता है।
4. तत्वों का वर्गीकरण किस प्रकार किया गया है ? आवर्त सारणी में वर्ग तथा आवर्त क्या हैं ?
उत्तर⇒ तत्वों के गुण उनके परमाणु क्रमाकों के आवर्त फलन होते हैं। जब तत्वों को उनके बढ़ते परमाणु संख्या के आधार पर रखा जाए तो समान गुणों वाले तत्व नियमित अंतर के बाद प्रकट होते हैं । इलेक्ट्रॉन विन्यास इसका मूल आधार है।
वर्ग : आवर्त सारणी में उर्ध्वाधर (खड़े) कालम समूह वर्ग कहलाते हैं।
आवर्त : आवर्त सारणी में क्षैतिज कॉलम आवर्त कहलाते हैं।
5. धनायन का आकार परमाणु से कम क्यों होता है ? व्याख्या कीजिए।
उत्तर⇒ धनायन को धन आयन भी कहते हैं। यह परमाणु द्वारा एक या एक से अधिक इलेक्ट्रॉन खो देने पर बनता है । इलेक्ट्रॉन खोने पर प्रायः शैलों की संख्या कम हो जाती है। इसलिए धनायन का आकार परमाणु के आकार से कम होता है।
6. न्यूलैंड्स के अष्टक नियम को लिखें।
उत्तर⇒ 1866 ई० में अंग्रेज वैज्ञानिक जॉन न्यलैंडस ने सात तत्त्वों को परमाणु द्रव्यमान के आरोही क्रम में व्यवस्थित किया। उन्होंने सबसे कम परमाणु द्रव्यमान वाले तत्त्व वाल तत्त्व हाइड्रोजन से आरंभ किया तथा 56वें तत्त्व थोरियम पर इसे समाप्त किया। उन्होंने पाया कि प्रत्येक आठवें तत्त्व का गणधर्म पहले तत्त्व के गुणधर्म के समान है। उन्होंने इसकी तुलना संगीत के अष्टक से की और इसलिए इन्होंने अष्टक का सिद्धांत कहा। इसे “न्यूलैंड्स का अष्टक सिद्धांत” कहा जाता है।
7. तत्त्वों के वर्गीकरण में डॉबेराइनर के क्या आधार थे ?
उत्तर⇒ डॉबेराइनर ने समान गुणधर्मों वाले तत्त्वों को समूहों में व्यवस्थित करने का प्रयास किया। उन्होंने तीन-तीन तत्त्व वाले कुछ समूहों को चुना एवं उन समूहों को त्रिक कहा। डॉबेराइनर ने बताया कि त्रिक के तीनों तत्त्वों का उनके परमाणु द्रव्यमान, के आरोही क्रम में रखने पर बीच वाले तत्त्व का परमाणु द्रवयमान अन्य दो तत्त्वों के परमाणु द्रव्यमान का लगभग औसत होता है।
8. आवर्त में बायीं से दायीं ओर जाने पर इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति कैसे परिवर्तित होगी ?
उत्तर⇒ आवर्त में बायीं से दायीं ओर बढ़ने पर बाहरी कोश में इलेक्ट्रॉनों की संख्या क्रमानुसार बढ़ती जाती है। अतः अष्टक की प्राप्ति में एकांतर रूप से कम इलेक्ट्रॉनों की आवश्यकता होगी। अतः इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति बढ़ती है।
9. तत्त्वों के इलेक्ट्रॉनिक विन्यास का आधुनिक आवर्त सारणी में तत्त्व की स्थिति से क्या संबंध है ?
उत्तर⇒ आधुनिक आवर्त सारणी तत्त्वों के परमाणु संख्या के आरोही क्रम में सजाया गया है। अगर एक तत्त्व Mg (परमाणु संख्या 12) है तो आवर्त सारणी में ऐलुमिनियम परमाणु संख्या 13 को एक ही आवर्त में रखा गया है। जबकि Mg समूह 2 में और ऐलुमिनियम समूह 13 में। Mg का इलेक्ट्रॉनिक विन्यास (2,8,2) है और Al का इलेक्ट्रॉनिक विन्यास (2,8,3) है। आवर्त में लगातार बायीं से दायीं ओर जाने पर संयोजकता इलेक्ट्रॉन में क्रमानुसार 1 इलेक्ट्रॉन की वृद्धि होती है। इसी प्रकार एक समूह (2) में Mg (12) और कैल्सियम परमाणु संख्या (20) लिया जाए तो इनका इलेक्ट्रॉनिक विन्यास (2,8,2) और (2,8,8,2) प्राप्त होता है। इन्हें एक समूह में रखा गया है, लेकिन Mg में तीन कोश और Cu में चार कोश प्राप्त है। दोनों तत्त्वों की संयोजकता समान (2) है। लेकिन Mg का परमाणु साइज Ca के परमाणु साइज से छोटा है। अतः इलेक्ट्रॉनिक विन्यास के आधार पर उनके परमाणु संख्या को ध्यान में रखकर तत्त्वों को आवर्त सारणी में स्थान दिया गया है। अतः तत्त्वों के इलेक्ट्रॉनिक विन्यास का आधुनिक आवर्त सारणी तत्त्वों की स्थिति से संबद्ध है। किसी भी तत्त्व को आवर्त सारणी में देखकर उसके बारे में अधिक से अधिक जानकारी प्राप्त की जा सकती है।
10. मेंडलीव के आवर्त सारणी की विसंगतियों को लिखें।
उत्तर⇒ मेंडलीव के आवर्त सारणी की विसंगतियाँ निम्न हैं –
(i) निश्चित रूप से आवर्त सारणी में हाइड्रोजन का नियत स्थान नहीं दिया जा सका है। यह मेंडलीव के आवर्त सारणी की पहली कमी थी। उन्होंने अपनी सारणी में हाइड्रोजन को उचित स्थान नहीं दे सके।
(ii) मेंडलीव आवर्त सारणी में समस्थानिकों और नोबल गैसों के लिए कोई स्थान नहीं दिया गया।
(iii) मेंडलीव आवर्त सारणी में एक तत्त्व से दूसरी तत्त्व की ओर बढ़ने पर परमाणु द्रव्यमान नियमित रूप से नहीं बढ़ते। इसलिए यह अनुमान लगाना होगा कि दो तत्त्वों के बीच कितने तत्त्व खोजे जा सकते हैं। जब भारी तत्त्वों पर विचार करते हैं तो कठिनाई उत्पन्न हो जाती है।
11. मेंडलीफ ने तत्त्वों का वर्गीकरण किस आधार पर किया ?
उत्तर⇒ मेंडलीफ ने अपनी सारणी में तत्त्वों को उनके मूल गुणधर्म, परमाणु द्रव्यमान तथा रासायनिक गुणधर्मों में समानता के आधार पर व्यवस्थित किया।
12. डॉबेराइनर के तत्त्वों के वर्गीकरण की क्या सीमाएँ थीं ?
उत्तर⇒
(i) उस समय तक ज्ञात सभी तत्त्वों का वर्गीकरण त्रिक के आधार पर नहीं हो सका।
(ii) यह त्रिक नियम कुछ ही तत्त्वों तक सीमित रहा।
(iii) उस समय तक ज्ञात तत्त्वों में केवल तीन त्रिक ही ज्ञात हो सके।
13. आवर्त में बायीं से दायीं ओर जाने पर परमाणु त्रिज्या क्यों घटती है ?
उत्तर⇒ नाभिक में आवेश के बढ़ने से यह इलेक्ट्रॉनों को नाभिक की ओर खींचता है जिससे परमाणु का आकार घटता है और इसकी परमाणु त्रिज्या घट जाती है।
14. उत्कृष्ट गैसों को अलग समूह में क्यों रखा गया है ?
उत्तर⇒ उत्कृष्ट गैसें He, Ar, Ne आदि के परमाणु क्रमांक क्रमश: 2, 18, 10 हैं। इनका इलेक्ट्रॉनिक विन्यास (2), (2, 8, 8), (2,8) है। इनकी संयोजकताएँ शून्य हैं अतः इन्हें अलग समूहों में रखा गया क्योंकि इनके इलेक्ट्रॉनिक विन्यास भिन्न-भिन्न हैं।
15. आपके अनुसार उत्कृष्ट गैसों को अलग समूहों में क्यों रखा गया ?
उत्तर⇒ चूँकि ये गैसें मेंडलीफ आवर्त सारणी के बनने के काफी बाद पाया गया, जिसे सारणी में खाली जगहों में रखा गया। सभी गैसें अभिक्रियाशील थे, अतः उन्हें एक अलग समूह में रखना उचित था।
16. समूह में इलेक्ट्रॉन त्यागने की प्रवृत्ति किस तरह बदलती है ?
उत्तर⇒ समूह में नीचे की ओर संयोजकता इलेक्ट्रॉन पर क्रिया करने वाला प्रभावी नाभिकीय आवेश घटता है, क्योंकि सबसे बाहरी इलेक्ट्रॉन नाभिक से दूर होते हैं। इसलिए यह इलेक्ट्रॉन सुगमतापूर्वक निकल जाते हैं।
17. समह में ऊपर से नीचे जाने पर संयोजकता किस प्रकार परिवर्तित होती है ?
उत्तर⇒ समूह में ऊपर से नीचे जाने पर तत्त्वों की संयोजकताएँ स्थिर रहती हैं। समूह 1 के तत्त्वों की संयोजकताएँ 1 और समूह 2 के तत्त्वों की संयोजकताएँ 2 होती हैं। इसी प्रकार समूह 3 और 4 के परमाणुओं की संयोजकताएँ 3 और 4 होंगी।
18. समूह में ऊपर से नीचे की ओर जाने पर इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति कैसे परिवर्तित होगी ?
उत्तर⇒ समूह में ऊपर से नीचे की ओर जाने पर अधातुओं में कोशों की संख्या बढ़ती है लेकिन संयोजकता इलेक्ट्रॉन समान रहती है। अत: इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति घटती है जबकि कोशों की संख्या बढ़ती है। अधातुओं में ऋणात्मकता की प्रवृत्ति रहती है जिससे यह इलेक्ट्रॉन ग्रहण करने की प्रवत्ति रखता है। लेकिन समह में ऊपर से नीचे आने पर इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति घटती है क्योंकि आयनाकरण उर्जा की कमी होती है।