महत्वपूर्ण तथ्य—
- सबसे कठोर धातु प्लैटिनम होता है।
- विद्युत तथा ऊष्मा की सबसे अच्छी चालक चाँदी होती है।
- लोहा का उद्योगों की जननी कहा जाता है।
- प्लैटिनम को सफेद सोना कहा जाता है।
- यूरेनियम को पीला केक कहा जाता है।
- तांबामानव द्वारा खोजी गई सबसे पहली धातु है।
- सबसे मुलायम धातु सोडियम होता है, जिसे चाकू से आसानी से काटा जा सकता है।
- सोडियम को किरोसीन तेल में रखा जाता है।
- सबसे हल्की धातु लिथियम तथा सबसे भारी धातु ओसमियम है।
- पारा एक ऐसा धातु है, जो कमरे के ताप पर द्रव अवस्था में रहता है।
- मुक्त अवस्था में पाया जाने वाला धातु सोना, चाँदी और प्लैटिनम है।
- ब्रोमीन एक ऐसा अधातु है, जो कमरे के ताप पर द्रव अवस्था में रहता है।
- सबसे अधिक सक्रिय अधातु फ्लोरिन है।
- क्लोरिन का इलेक्ट्रॉन बंधुता सबसे अधिक होता है।
- सबसे हल्की गैस हाइड्रोजन है।
- हीलियम गैस का उपयोग गुब्बारे में किया जाता है।
- सबसे अधिक गलनांक टंगस्टन का बना होता है।
- विद्युत बल्ब का फिलामेंट टंगस्टन का बना होता है।
- विद्युत बल्ब में आर्गन और नाइट्रोजन गैस भरी जाती है।
- सिलिका एक उपधातु है।
- सांद्र हाइड्रोक्लोरिक अम्ल और सांद्र नाइट्रिक अम्ल का ताजा मिश्रण एक्वारेजिया कहलाता है।
- एंटिमनी एक उपधातु है।
- बॉक्साइट एलुमिनियम धातु का अयस्क है।
- सीसा और टिन के मिश्रधातु को सोल्डर कहा जाता है।
- पीतल एक मिश्रधातु है, जिसमें ताँबा (80 ) और जिंक (20 ) होता है।
- एलुमिनियम पर मोटी ऑक्साइड की परत बनाने की क्रिया को एनोडीकरण कहते हैं।
- चाँदी को हवा में छोड़ देने पर उस पर काले रंग की परत जम जाती है।
धातु– वैसे तत्त्व जो विद्युतधनात्मक, आघातवर्धनीय, तन्य, उष्मा तथा विद्युत का सुचालक, चमकीला और कठोर होते हैं, उसे धातु कहते हैं। जैसे- सोडियम, मैग्नीशियम, जिंक, लेड, कॉपर, ताँबा, सोना, ऐलुमिनियम आदि।
अधातु– वैसे तत्त्व जो विद्युतधनात्मक, आघातवर्धनीय, तन्य, उष्मा तथा विद्युत का सुचालक, चमकीला और कठोर नहीं होते हैं, उसे अधातु कहते हैं। जैसे- कार्बन, सल्फर, आयोडिन, क्लोरिन, ऑक्सीजन, नाइट्रोजन आदि।
धातुओं के भौतिक गुण–
1. धातुएँ विद्युत धनात्मक होती है।
2. धातुएँ आघातवर्धनीय होती हैं।
3. धातुएँ तन्य होती हैं।
4. धातुओं के द्रवनांक एवं क्वथनांक उच्च होते हैं।
5. धातुएँ विद्युत और ऊष्मा की सुचालक होती है।
6. धातुओं में एक विशेष प्रकार की चमक होती है।
7. धातुएँ कठोर होती है।
8. धातुओं को हथौड़े से पीटने पर एक विशेष प्रकार की ध्वनि उत्पन्न होती है।
9. धातुएँ कमरे के ताप पर सामान्यतः ठोस होती है।
धातुओं के रासायनिक गुण–
1. सभी धातुएँ ऑक्सीजन के साथ संयोग करके ऑक्साइड बनाती है।
4Na + O2→ 2Na2O (सोडियम मोनोक्साइड)
2Mg + O2→ 2MgO (मैग्नीशियम मोनोक्साइड)
2. धातुएँ अम्लों के साथ अभिक्रिया करके प्रायः हाइड्रोजन गैस मुक्त करती है।
2Na + HCl → 2NaCl + H2↑
अधातुओं के भौतिक गुण–
1. अधातुएँ सामान्य ताप पर, ब्रोमीन को छोड़कर, ठोस एवं गैस के रूप में पाई जाती है।
2. अधातुएँ प्रायः भंगुर होती है।
3. अधातुओं में प्रायः कोई विशेष चमक नहीं होती है।
4. अधातुएँ ऊष्मा और विद्युत की कुचालक होती है।
5. अधातुएँ मुलायम होती है।
6. हथौड़े से पीटने पर अधातुओं में कोई ध्वनि नहीं निकलती है।
7. हाइड्रोजन को छोड़कर सभी धातुएँ विद्युत ऋणात्मक होती है।
अधातुओं के रासायनिक गुण–
1. अधातुएँ ऑक्सीजन के साथ संयोग करके अम्लीय ऑक्साइड बनाती है।
C + O2 → CO2
S + O2 → SO2
2. अधातुएँ जल के साथ अभिक्रिया नहीं करती हैं।
भौतिक गुणों के आधार पर धातु और अधातु में अंतर–
1. धातुओं में एक विशेष प्रकार की चमक होती है जबकि अधातुओं में ऐसी कोई चमक नहीं होती है। अपवाद- आयोडिन और ग्रैफाइट में धातुई चमक होती है।
2. धातुएँ प्रायः विद्युत धनात्मक होती है जबकि अधातुएँ प्रायः विद्युत ऋणात्मक होती है। सिर्फ हाइड्रोजन विद्युत धनात्मक होता है।
3. धातुएँ प्रायः ऊष्मा एवं विद्युत की सुचालक होती है जबकि अधातुएँ प्रायः ऊष्मा एवं विद्युत की कुचालक होती है। सिर्फ हाइड्रोजन एवं ग्रैफाइट विद्युत की सुचालक होती है।
4. साधारण ताप पर धातुएँ प्रायः ठोस होती है। सिर्फ मरकरी (पारा) ही ऐसी धातु है जो साधारण ताप पर द्रव होती है। जबकि अधातुएँ साधारण ताप पर ठोस या गैस होती है।सिर्फ ब्रोमीन साधारण ताप पर द्रव होती है।
5. धातुएँ आघातवर्धनीय तथा तन्य होती है जबकि अधातुएँ आघातवर्धनीय तथा तन्य नहीं होती हैं। अपवाद- प्लास्टिक गंधक तन्य होता है।
6. धातुओं के घनत्व उच्च होते हैं जबकि अधातुओं के घनत्व निम्न होते हैं।
7. हथौड़े से पीटने पर धातुओं से एक विशेष प्रकार की ध्वनि निकलती है जबकि अधातुओं को हथौड़े से पीटने पर टूट कर चूर हो जाती हैं।
रासायनिक गुणों के आधार पर धातु और अधातु में अंतर–
1. धातुओं के परमाणु धनायन बनाते हैं, जैसे- K+ , Na+, Ca2+ आदि। जबकि अधातुओं के परमाणु ऋणायन बनाते हैं। जैसे- Cl– , Br– , S2- आदि।
2. धातुओं के ऑक्साइड भास्मिक होते हैं
CaO + H2O → Ca (OH) 2
जबकि अधातुओं के ऑक्साइड अम्लीय होते हैं। ये जल से अभिक्रिया करके अम्ल बनाते हैं।
CO2 + H2O→ H2CO3
रासायनिक बंधन– वह रासायनिक बल जो किसी अणु में परमाणुओं को एकसाथ बाँधकर रखता है, रासायनिक बंधन कहलाता है।
रासायनिक बंधन के प्रकार–
1. वैद्युत संयोजक बंधन या आयनिक बंधन
2. सहसंयोजक बंधन
1. वैद्युत संयोजक बंधन या आयनिक बंधन–दो परमाणुओं के बीच एक परमाणु से दूसरे परमाणु में एक या अधिक इलेक्ट्रॉनों के स्थानांतरण के फलस्वरूप बने रासायनिक बंधन को वैद्युत संयोजक बंधन या आयनिक बंधन कहते हैं। इसक ध्रुवीय बंधन भी कहते हैं।
जैसे- सोडियम क्लोराइड का बनना
Na+ + Cl–→ Na+Cl–
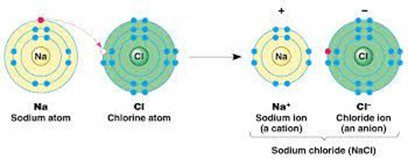
वैद्युत संयोजकता– किसी तत्त्व के परमाणु के आयन में परिवर्तित होने के लिए त्यक्त या प्राप्त इलेक्ट्रॉनों की संख्या उस तत्त्व की वैद्युत संयोजकता कहलाती है। जैसे- सोडियम क्लोराइड के बनने में सोडियम परमाणु एक इलेक्ट्रॉन का त्याग और क्लोरिन का परमाणु एक इलेक्ट्रॉन प्राप्त करता हैं। अतः सोडियम की वैद्युत संयोजकता +1 और क्लोरीन की वैद्युत संयोजकता -1 होती है। इसी प्रकार Mg, Ca और Be की संयोजकता +2 होती है।
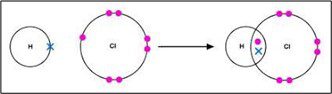
सहसंयोजक बंधन–जब दो परमाणु आपस में इलेक्ट्रॉनों का साझा करके अपना अष्टक पूरा करते हैं तब उनके बीच बना हुआ रासायनिक बंधन सहसंयोजक बंधन कहलाता है।
सहसंयोजक बंधन तीन प्रकार के होते हैं।
1. एकल सहसंयोजक बंधन
2. द्विक सहसंयोजक बंधन
3. त्रिक सहसंयोजक बंधन
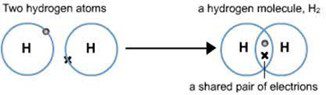
एकल सहसंयोजक बंधन–जब दो परमाणुओं के बीच इलेक्ट्रॉनों के सिर्फ एक युग्म साझा होता है तब उनके बीच बने बंधन को एकल सहसंयोजक बंधन कहते हैं।
हाइड्रोजन अणु का बनना
मेथेन अणु का बनना
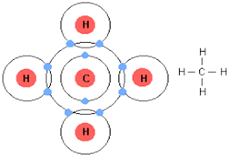
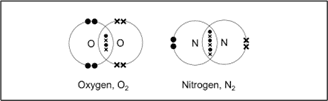
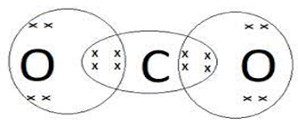
द्विक सहसंयोजक बंधन–जब संयोग करने वाले दोनों परमाणु दो-दो इलेक्ट्रॉनों का साझा करते हैं तब उनके बीच बने बंधन को द्विक सहसंयोजक बंधन कहते हैं।
कार्बन डाइऑक्साइड का बनना–
ऑक्सीजन का बनना–
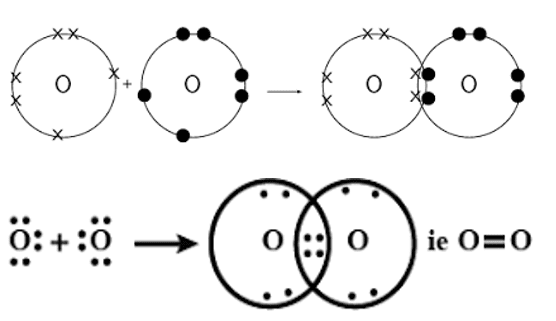
त्रिक सहसंयोजक बंधन या त्रिबंधन– जब संयोग करनेवाले दो परमाणु तीन-तीन इलेक्ट्रॉनों का साझा करते है तब उन परमाणुओं के बीच बने बंधन को त्रिक सहसंयोजक बंधन कहते हैं।
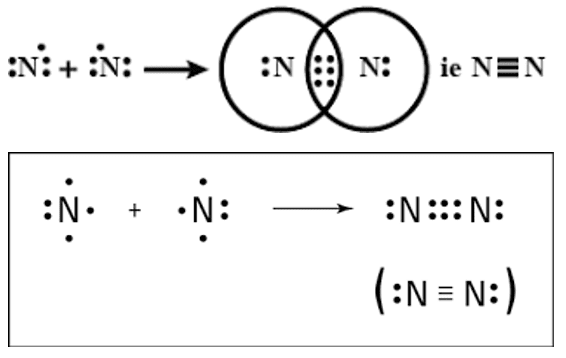
खनिज– पृथ्वी की परत में विद्यमान धातुयुक्त ठोस पदार्थ (तत्त्व या यौगिक) खनिज कहलाते हैं।
जैसे- प्रकृति में पाए जानेवाले सोडियम क्लोराइड(NaCl), कैल्सियम कार्बोनेट (CaCO3) आदि खनिज है।
अयस्क– जिस खनिज में प्रचुर मात्रा में धातु विद्यमान हो तथा जिससे कम खर्च में ही एवं सरलता से धातु प्राप्त की जा सके, उसे अयस्क कहते हैं।
जैसे- बॉक्साइड (Al2O3 . 2H2O) और मिट्टी (Al2O3 . 2SiO2 . 2H2O) दोनों ऐल्युमिनियम के खनिज हैं।
धातुकर्म– अयस्कों से धातुओं के निष्कर्षण एवं उनके शोधन की प्रक्रिया धातुकर्म कहलाती है।
गैंग– अयस्कों में उपस्थित अवांछनीय पदार्थ जैसे बालू, कंकड़ या मिट्टी के टुकड़े आदि को गैंग कहते हैं।
अयस्क का सान्द्रण– अयस्क में विद्यमान अपद्रव्यों को दूर करना अयस्क का सांद्रण कहलाता है।
निस्तापन– अयस्क को उच्च ताप पर वायु की अनुपस्थिति या अपर्याप्त आपूर्ति में उसके द्रवणांक से कम ताप पर धातु को ऑक्साइड में परिवर्तित करने की प्रक्रिया निस्तापन कहलाती है।
भर्जन– सल्फाइड अयस्कों को वायु की पर्याप्त आपूर्ति की स्थिति में तीव्रता से गर्म करके धातु को ऑक्साइड में परिवर्तित करने की प्रक्रिया को भर्जन कहते हैं।
गालक– गालक वह पदार्थ है जिसे निस्तापित या भर्जित अयस्क एवं कोक के साथ मिश्रित कर मिश्रण को गर्म किया जाता है।
धातुमल– द्रावक अयस्क में उपस्थित अद्रवणशील अपद्रव्यों के साथ संयोग करके उन्हें द्रवणशील पदार्थ में परिवर्तित कर देता है, जिसे धातुमल कहते हैं।
प्रगलन– धातु के ऑक्साइड को कोक के साथ गर्म करके उसे धातु में परिवर्तित करने की प्रक्रिया प्रगलन कहलाती है।
जस्ता या जिंक के प्रमुख अयस्क–
1. जिंक ब्लेंड (ZnS)
2. कैलेमाइन (ZnCO3)
3. जिंकाइट (ZnO)
पारा का प्रमुख अयस्कसिनेबारहै।
ऐलुमिनियम के प्रमुख अयस्क हैं–
1. बॉक्साइट (Al2O3. 2H2O)
2. कोरंडम (Al2O3)
3. क्रायोलाइट (Na3AlF6)
संक्षारण– धातु की सतह पर वायु के ऑक्सीजन, कार्बन डाइऑक्साइड, जलवाष्प, सल्फर डाइऑक्साइड, हाइड्रोजन सल्फाइड आदि की अभिक्रिया के फलस्वरूप धातु का क्षय धातु का संक्षारण कहलाता है।
संक्षारण रोकने का उपाय–
धातु की सतह पर लेप चढ़ाकर– धातु की बाहरी सतह पर ग्रीज या वार्निश की एक पतली परत चढ़ा कर उसके संक्षारण को रोका जा सकता है।
रंगाई करके– धातु की सतह को किसी अम्ल अवरोधक रंग से रंगाई कर देने से धातुओं के संक्षारण को रोका जा सकता है।
जस्तीकरण करके– धातु की किसी पिघले हुए जस्ता में डुबा देने से वस्तु की सतह पर जस्ता की एक परत बैठ जाती है। जिससे जंग लगने से बचाया जा सकता है।
विद्युतलेपन द्वारा– वैद्युत अपघटन प्रक्रिया द्वारा किसी धातु पर किसी अन्य धातु का लेप चढ़ा कर संक्षारण से बचाया जा सकता है।
मिश्रधातु– दो या अधिक धातुओं अथवा एक धातु एवं एक अधातु का समांग मिश्रण मिश्रधातु कहलाता है।
जैसे- पीतल, ताँबा एवं जस्ता का मिश्रधातु है।
मिश्रधातु के गुण–
* ये अपने अवयवों से अधिक कठोर होते हैं।
* ये संक्षारण-अवरोधक होते हैं।
* इनके द्रवनांक एवं इनकी विद्युत चालकता उनके अवयवों की अपेक्षा कम होते हैं। जैसे पीतल विद्युत का अच्छा चालक नहीं है, जबकि इसका अवयव ताँबा विद्युत का अच्छा चालक है।
*इनकी गुणवत्ता इनके अवयवों की तुलना में बढ़ जाती है।
वस्तुनिष्ठ प्रश्न
1.अमलगम एक मिश्रधातु है जिसमें एक धातु हमेशा रहता है –
( A ) कॉपर
( B ) सिल्वर
( C ) पारा
( D ) सोना
Ans :- ( C ) पारा
2. निम्न में से कौन-सा पदार्थ ऑक्सीजन से संयोग नहीं करता है ?
( A ) ताँबा
( B ) गोल्ड
( C ) जिंक
( D ) पोटाशियम
Ans :- ( B ) गोल्ड
3. कौन विद्युत का सर्वोत्तम सुचालक है ?
( A ) Cu
( B ) Ag
( C ) AI
( D ) Fe
Ans :- ( B ) Ag
4. बॉक्साइट निम्नलिखित में से किस धातु का मुख्य अयस्क है ?
( A ) लोहा
( B ) कैल्सियम
( C ) सोडियम
( D ) ऐल्युमिनियम
Ans :- ( D ) ऐल्युमिनियम
5. निम्नांकित में कौन उपधातु है ?
( A ) Fe
( B ) Cu
( C ) Ni
( D ) Sb
Ans :- ( D ) Sb
6. शुद्ध सोना को व्यक्त किया जाता है ?
( A ) 22 कैरेट
( B ) 24 कैरेट
( C ) 20 कैरेट
( D ) 12 कैरेट
Ans :- ( B ) 24 कैरेट
7. पीतल है-
( A ) धातु
( B ) अधातु
( C ) मिश्रधातु
( D ) उपधातु
Ans :- ( C ) मिश्रधातु
8. निम्नलिखित में से किसे चाकू से काटा जा सकता है ?
( A ) लिथियम
( B ) कैल्शियम
( C ) कॉपर
( D ) आयरन
Ans :- ( A ) लिथियम
9. निम्न में से कौन आयनिक यौगिक है ?
( A ) CH₄
( B ) CO₂
( C ) CaCl₂
( D ) NH₃
Ans :- ( C ) CaCl₂
10. निम्न में से कौन अधातु है ?
( A ) Fe
( B ) C
( C ) Al
( D ) Au
Ans :- ( B ) C
11. सक्रियता श्रेणी में हाइड्रोजन के ऊपर के धातु –
( A ) अम्लों से अभिक्रिया कर हाइड्रोजन आयन बनाते हैं
( B ) अम्लों से अभिक्रिया कर हाइड्रोजन गैस बनाते हैं
( C ) साधारण ताप पर जल से अभिक्रिया करते हैं
( D ) इनमें से कोई नहीं
Ans :- ( B ) अम्लों से अभिक्रिया कर हाइड्रोजन गैस बनाते हैं
12. उच्च विद्युत धनात्मकता के कारण धातु के परमाणु बनाते हैं :
( A ) धनायन
( B ) ऋणायन
( C ) उदासीन आयन
( D ) सहसंयोजक बंधन
Ans :- ( A ) धनायन
13. धातु के ऑक्साइड सामान्यतः होते हैं
( A ) अम्लीय
( B ) क्षारकीय
( C ) उभयधर्मी
( D ) उदासीन
Ans :- ( B ) क्षारकीय
14. अयस्क से चुम्बकीय अशुद्धियों को दूर करने के लिए जो विधि प्रयुक्त जाती है वह है :
( A ) हाथ से चुनने की विधि
( B ) गुरुत्व पृथक्करण विधि
( C ) फेन-प्लवन विधि
( D ) चुम्बकीय पृथक्करण विधि
Ans :- ( D ) चुम्बकीय पृथक्करण विधि
15. सल्फाइड अयस्कों का सांद्रण किया जाता है :
( A ) हाथ से चुनकर
( B ) निक्षालन द्वारा
( C ) फेन-प्लवन द्वारा
( D ) निस्तापन द्वारा
Ans :- ( C ) फेन-प्लवन द्वारा
16. निम्नलिखित में से कौन ऐल्युमिनियम का मिश्रधातु है ?
( A ) मैग्नेलियम
( B ) जर्मन सिल्वर
( C ) पीतल
( D ) काँसा
Ans :- ( A ) मैग्नेलियम
17. कॉपर का निष्कर्षण मुख्यत: किस अयस्क से किया जाता है ?
( A ) कॉपर ग्लांस (Cu₂S)
( B ) कॉपर पाइराइट्स (CuFes₂)
( C ) क्यूपराइट (Cu₂0)
( D ) इनमें से कोई नहीं
Ans :- ( B ) कॉपर पाइराइट्स (CuFes₂)
18. किसी अधातु के परमाणु के बाह्यतम शेल में इलेक्ट्रॉनों की संख्या होती है ?
( A ) 1, 2, 3 या 4
( B ) 2, 3, 4 या 5
( C ) 4, 5, 6, 7 या 8
( D ) 4, 5, 1 या 2
Ans :- ( C ) 4, 5, 6, 7 या 8
19. साधारण गंधक किस आण्विक रूप में पाया जाता है ?
( A ) S
( B ) S₃
( C ) S₈
( D ) S₄
Ans :- ( C ) S₈
20. फॉस्फोरस का आण्विक सूत्र होता है :
( A ) P
( B ) P₂
( C ) P₈
( D ) P₄
Ans :- ( D ) P₄
21. सोना निम्नलिखित में से किस द्रव में घुल जाता है ?
( A ) अम्लराज में
( B ) सांद्र सल्फ्यूरिक अम्ल में
( C ) सांद्र नाइट्रिक अम्ल में
( D ) इनमें से सभी में
Ans :- ( A ) अम्लराज में
22. कौन-सा अधातु कमरे के ताप पर द्रव होता है ?
( A ) ब्रोमीन
( B ) पारा
( C ) ताँबा
( D ) एलुमिनियम
Ans :- ( A ) ब्रोमीन
23. सीसा और टीन की मिश्रधातु को कहते हैं ?
( A ) सोल्डर
( B ) स्टील
( C ) गन मेटल
( D ) उपधातु
Ans :- ( A ) सोल्डर
24. निम्नलिखित में से कौन अधिक अभिक्रियाशील है ?
( D ) Cu
( B ) Hg
( C ) Ag
( D ) Au
Ans :- ( D ) Cu
25. निम्नलिखित में से कौन अतिज्वलनशील है ?
( A ) लाल फॉस्फोरस
( B ) श्वेत फॉस्फोरस
( C ) साधारण गंधक
( D ) प्लैस्टिक गंधक
Ans :- ( B ) श्वेत फॉस्फोरस
26. विद्युत अपघटनी परिष्करण में अशुद्ध धातु को बनाया जाता है ?
( A ) एनोड
( B ) कैथोड
( C ) अपघट्य
( D ) इनमें सभी
Ans :- ( A ) एनोड
27. निम्नलिखित में कौन सबसे अधिक अभिक्रियाशील धातु है ?
( A ) Mg
( B ) Ca
( C ) Na
( D ) K
Ans :- ( D ) K
28. वल्कनीकरण की प्रक्रिया में प्राकृतिक रबर के साथ निम्नलिखित में से क्या मिलाया जाता है?
( A ) साधारण गंधक
( B ) एकनताक्ष गंधक
( C ) अष्ठफलकी गंधक
( D ) श्वेत फॉस्फोरस
Ans :- ( A ) साधारण गंधक
29. 1 ग्राम सोना से कितना लंबा तार बनाया जा सकता है ?
( A ) 1 km
( B ) 2 km
( C ) 3 km
( D ) 4 km
Ans :- ( B ) 2 km
30. कमरे के ताप पर मर्करी धातु किस अवस्था में पाई जाती है ?
( A ) ठोस
( B ) द्रव
( C ) गैस
( D ) कोई भी
Ans :- ( B ) द्रव
31. व्यवसायिक स्तर पर ऐल्युमिनियम धातु का निष्कर्षण किस अयस्क से किया जाता है ?
( A ) क्रायोलाइट (Na₃AIF₆)
( B ) बॉक्साइट (Al₂O₃.2H₂O)
( C ) कोरण्डम (AL₂0₃)
( D ) इनमें से कोई नहीं
Ans :- ( B ) बॉक्साइट (Al₂O₃.2H₂O)
32. लोहे के निष्कर्षण में चूना-पत्थर कैल्सियम सिलिकेट (CaSiO₄.) एक यौगिक बनाता है| यह यौगिक कहलाता है ?
( A ) भर्जन (जारण)
( B ) प्रगलन
( C ) द्रावक
( D ) धातुमल
Ans :- ( D ) धातुमल
33. किसी तत्व के गुणधर्म का दो या दो से अधिक विभिन्न रूपों में. प्रस्तुतीकरण तत्व की क्या कहलाती है ?
( A ) अपरूपता
( B ) समावयवता
( C ) समरूपता
( D ) उभधर्मियता
Ans :- ( A ) अपरूपता
34. धातुओं की प्रकृति होती है:
( A ) विद्युत धनात्मक
( B ) विद्युत ऋणात्मक
( C ) उदासीन
( D ) कोई नहीं
Ans :- ( A ) विद्युत धनात्मक
35. लोहा एवं इस्पात को जंग से सुरक्षित रखने के लिए उन पर किस धातु की पतली परत चढ़ाई जाती है?
( A ) ताँबा
( B ) चाँदी
( C ) सोना
( D ) जिंक
Ans :- ( D ) जिंक
36. किस रासायनिक यौगिक को गर्म करने पर ‘प्लास्टर ऑफ पेरिस (Plaster of Paris) प्राप्त किया जा सकता है ?
( A ) विरंजक चूर्ण
( B ) जिप्सम
( C ) चूना पत्थर
( D ) कच्चा चूना
Ans :- ( B ) जिप्सम
37. अभिक्रियाशीलता के इस क्रम में कौन सही है?
( A ) Al > Mg > Zn > Fe
( B ) Zn > Al > Mg > Fe
( C ) Mg > Al > Zn > Fe
( D ) Fe > Zn > Al > Mg
Ans :- ( C ) Mg > Al > Zn > Fe
38. एक्वारेजिया (रॉयल जल) किस अनुपात में सान्द्र हाइड्रोक्लोरिक अम्ल एवं सांद्र नाइट्रिक अम्ल का ताजा मिश्रण होता है ?
( A ) 3:2
( B ) 2:3
( C ) 3:1
( D ) 1:3
Ans :- ( C ) 3:1
39. अपने शुद्ध रूप में धातु की सतह होती है :
( A ) चमकदार
( B ) खुरदुरा
( C ) काला
( D ) इनमें से कोई नहीं
Ans :- ( A ) चमकदार
40. धातु का पतले तार के रूप में खींचने की क्षमता को क्या कहते है ?
( A ) आघातवर्ध्यता
( B ) तन्यता
( C ) लचीलापन
( D ) इनमें से कोई नहीं
Ans :- ( B ) तन्यता
41. कुछ धातुओं को पीटकर पतली चादर बनाया जा सकता है । इस गुणधर्म को क्या कहते है ?
( A ) तन्यता
( B ) आघातवर्ध्यता
( C ) दोनों
( D ) इनमें से कोई नहीं
Ans :- ( B ) आघातवर्ध्यता
42. जो धातुएँ कठोर सतह से टकराने पर आवाज उत्पन्न करती है| उन्हें क्या कहते है?
( A ) तन्यता
( B ) ध्वानिक (सोनोरस)
( C ) आघातवर्ध्यता
( D ) इनमें से कोई नहीं
Ans :- ( B ) ध्वानिक (सोनोरस)
43. सबसे अधिक तन्य धातु कौन है ?
( A ) चाँदी
( B ) ताँबा
( C ) एल्यूमिनियम
( D ) सोना
Ans :- ( D ) सोना
44. इनमें से कौन अधातु होते हुए भी चमकीला होता है ?
( A ) कार्बन
( B ) ब्रोमीन
( C ) आयोडीन
( D ) इनमें से कोई नहीं
Ans :- ( C ) आयोडीन
45. सबसे कठोर प्राकृतिक पदार्थ कौन है ?
( A ) लीथियम
( B ) हीरा
( C ) सोडियम
( D ) पोटैशियम
Ans :- ( B ) हीरा
46. ऐल्युमिनियम पर मोटी ऑक्साइड की परत बनाने की प्रक्रिया को क्या कहते है।
( A ) ऐथोडीकरण
( B ) कैथोडीकरण
( C ) दोनों
( D ) इनमें से कोई नहीं
Ans :- ( A ) ऐथोडीकरण
लघु उत्तरीय प्रश्न
1. धातु किसे कहते हैं ?
उत्तर⇒ आवर्त सारणी के बायीं तरफ तथा मध्य में रखे जाने वाले तत्त्व धातु कहलाते हैं, जिनमें धात्विक चमक होती है । वे प्रायः तन्य, आघातवर्ध्य, विद्युत् और ऊष्मा की सुचालक, दृढ़ और अधिक घनत्व वाली होती हैं। इनके ऑक्साइड क्षारीय प्रकृति के होते हैं । लोहा, सोना, चाँदी, ताँबा, प्लैटिनम आदि धातुओं के उदाहरण हैं ।
2. धातुओं के दो रासायनिक गणों को लिखें।
उत्तर⇒(i) धातुओं के ऑक्साइड क्षारीय होते हैं।
(ii) अम्लों से अभिक्रिया कर हाइड्रोजन गैस विस्थापित करते हैं।
2Na +2HCL→ 2NaCl + H 2
3. अधातु के दो गुणधर्मों को लिखें।
उत्तर⇒ (i) अधिकतर अधातुएँ गैसीय अवस्था में पाये जाते हैं।
(ii) अधातुएँ सोनोरस ध्वनि उत्पन्न नहीं करते हैं।
4. कौन-सी धातुएँ आसानी से संक्षारित नहीं होती हैं ?
उत्तर⇒ सोना और चाँदी ऐसी धातुएँ हैं जो अभिक्रियाशीलता श्रेणी में सबसे नीचे आती हैं। ये धातुएँ काफी कम अभिक्रियाशील हैं। ऐसी धातुएँ आसानी से संक्षारित नहीं होती हैं।
5. धातुओं का परिष्करण से क्या तात्पर्य है ?
उत्तर⇒ अपचयन प्रक्रम से प्राप्त धातुएँ शुद्ध नहीं होती हैं। इनमें अपद्रव्य होती हैं। शुद्ध धातु की प्राप्ति इन अपद्रव्यों को धातु से हटाकर किया जाता है। अत: अशुद्ध धातुओं से अपद्रव्यों को हटाना धातुओं का परिष्करण कहा जाता है।
6. ऐसा धातु का उदाहरण दीजिए जो-
(i) कमरे के ताप पर द्रव होता है।
(ii) चाकू से आसानी से काटा जा सकता है।
(iii) ऊष्मा का सबसे अच्छा चालक हाता है।
(iv) ऊष्मा का कुचालक होता है।
उत्तर⇒ (i) पारा (ii) सोडियम तथा पोटाशियम, (iii) सोना और चांदी (iv) लेड तथा मरकरी।
7. मिश्रधातु क्या है ? तांबे के मिश्रधातु के दो उदाहरण दें।
उत्तर⇒ किसी धातु में अन्य धातु या अधातु की एक निश्चित मात्रा मिलाकर इच्छित गुण-धर्म वाली मिश्रधातुएँ प्राप्त की जा सकती हैं। ताम्बे के दो मिश्रधातु निम्नांकित हैं—पीतल और काँसा। पीतल में 80% Cu और काँसा में 90% Cu पाया
जाता है।
8. धातुएँ विद्युत के सुचालक क्यों होती हैं ?
उत्तर⇒ धातुएँ विद्युत के अच्छे चालक होते हैं। ये विद्युत धनात्मक भी हैं। इसमें इलेक्ट्रॉन त्यागने की प्रवृत्ति तीव्र होती है। ये ताप और विद्युत के सुचालक होते हैं। इसके तार से होकर विद्युत का प्रवाह आसानी से की जा सकती है। धातुओं को चालकता उनमें उपस्थित मुक्त इलेक्ट्रॉन के कारण होती है। ये इलेक्ट्रॉन धातु से होकर आसानी से दौड़ सकत हैं। यही कारण है कि धातु विद्युत और ताप के अच्छे चालक हैं।
9. संयोजकता से आप क्या समझते हैं ?
उत्तर⇒ किसी भी तत्त्व को संयाजकता उसक परमाण के सबसे बाहरी काश में उपस्थित संयाजकता इलक्ट्रॉनों की संख्या से निर्धारित होती है। मान लिया कि एक तत्त्व Na है। इसका परमाणु संख्या: 11 है। इसका इलेक्ट्रॉनिक विन्यास 2,8,1 है। अत: परमाण के बाहरी काश में इलेक्ट्रॉन संख्या । है। अत: इसकी संयोजकता 1 होगी।
10. आघातवर्थ्य तथा तन्य का अर्थ बताइए।
उत्तर⇒ कुछ धातुओं को पीटकर उनके चद्दर बनाए जाते हैं। इस गुणधर्म का आघातवर्थ्यता कहते हैं और धातु आघातवर्ध्य कहलाती है। किसी धातु के पतले तार खींचे जा सकते हैं। धातुओं के इस गुणधर्म को तन्यता कहते हैं तथा धातु तन्य कहलाती है। एक ग्राम सोने से 2 किमी लंबा तार बनाया जा सकता है।
11. संक्षारण से क्या समझते हैं?
उत्तर⇒ जब धात सतह जल, वायु अथवा आस-पास के अन्य किसा पदार्थ से प्रभावित होती है, तो इसे धातु का संक्षारित होना कहते हैं तथा इस परिघटना का संक्षारण कहा जाता है। गोल्ड तथा सिल्वर जैसी उत्कष्ट धातएँ सुगमतापूर्वक संक्षारित नहीं होती हैं। एलुमिनियम जैसी धातुएँ संक्षारित नहीं होती हैं।
12. संक्षारण से बचने की तीन विधियों को लिखें।
उत्तर⇒ संक्षारण रोकने की तीन विधियाँ –
(i) यशदलेपन द्वारा
(ii) विद्युत लेपन द्वारा
(iii) एनोडीकरण द्वारा
13. एक धातु और एक अधातु का नाम लिखें जो वायु के सम्पर्क में आने पर जल उठते हैं ?
उत्तर⇒ सोडियम धातु वायु के सम्पर्क में आन पर वायमंडलीय सामान्य ताप पर ही जल उठते हैं। श्वेत फॉस्फोरस अधातु है इसे पानी में डुबाकर रखा जाता है। यह वायु के सम्पर्क में आते ही जल उठता है।
14. जब धातुएँ नाइट्रिक अम्ल से अभिक्रिया करती है तो हाइड्रोजन गैस उत्सर्जित नहीं होता है। क्यों ?
उत्तर⇒ क्योंकि HNO3 एक प्रबल ऑक्सीकारक है जो उत्पन्न हाइड्रोजन का ऑक्सीकृत करके जल में परिवर्तित कर देता है एवं स्वयं नाइट्रोजन के किसी ऑक्साइड (N2O, NO, NO2 ) में अपचयित हो जाता है। लेकिन Mn ही एक ऐसा धातु है जो अति तनु HNO3 के साथ अभिक्रिया कर H2 गैस उत्पन्न करता है।
15. एनोड पंक क्या है? उदाहरण के साथ समझावें।
उत्तर⇒ विद्युत शोधन में जब विद्युत धारा प्रवाहित की जाती है तब एनोड पर स्थित अशद्ध धातु केटायन के रूप में घोल में जाने लगती है। उतनी ही मात्रा में शुद्ध धातु कैथोड पर जमा होती है। घुलनशील अशुद्धियाँ घोल में चली जाती हैं। अघुलनशील अशुद्धियाँ एनोड के नीचे जमा हो जाती हैं। इन्हें एनोड पंक कहते हैं।
16. निम्न पदों की परिभाषा दें–
(i) खनिज
(ii) अयस्क
(iii) गैंग
(iv) निस्तापन
(v) भर्जन
उत्तर⇒
(i) खनिज- भू-पर्पटी में प्राकृतिक रूप से पाए जाने वाले तत्त्वों या यौगिकों को खनिज कहते हैं। ये प्रायः खानों से निकाले जाते हैं।
(ii) अयस्क- वैसे खनिज जिनसे धातु का व्यावसायिक उत्पादन होता है, अयस्क कहलाते हैं। अयस्कों में धातु प्रचुर मात्रा में उपस्थित होते हैं। इससे धात का उत्पादन सरलता से कम खर्च में होता है।
(iii) गैंग- पथ्वी से प्राप्त खनिज अयस्कों में मिट्टी, रेत आदि कई अशद्धियाँ होती हैं। धातओं के निष्कर्षण स पहल अयस्क से अशुद्धियों को हटाना आवश्यक होता है। ये अशुद्धियाँ गैंग कहे जाते हैं। अयस्कों को गैंग से हटाने के लिए जिन प्रक्रियाओं का उपयोग होता है वे अयस्क एवं गैंग के भौतिक अथवा रासायनिक गुण धर्मों पर आधारित होते हैं। इनके पृथक्करण के लिए विभिन्न तकनीकों का उपयोग किया जाता है।
(iv) निस्तापन- अयस्क को उसके द्रवणांक से कम तापक्रम पर तीव्रता से गर्म करने की क्रिया जिससे उड़नशील अशुद्धियाँ बाहर निकल जाती हैं और ऑक्सीलवण ऑक्साइड में परिणत हो जाता है निस्तापन कहा जाता है। .
(v) भर्जन-अयस्क को वायु की अनियंत्रित आपूर्ति में उसके द्रवणांक से कम तापक्रम पर तीव्रता से गर्म करने की क्रिया भर्जन कहलाती है। इसमें अशुद्धियाँ ऑक्सीकृत होकर बाहर निकल जाती है।
17. आघातवर्ध्यता से क्या समझते हैं ?
उत्तर⇒ कुछ धातुओं को पीटकर चद्दर बनाए जाते हैं। इस गुणधर्म का आघातवर्ध्यता कहते हैं। इसी गुण के कारण एलुमिनियम के चद्दर, लोहे के चद्दर आदि बनाए जाते हैं।
18. पोटैशियम तथा सोडियम धातुओं को किरोसीन तेल में डुबाकर क्यों रखा जाता है?
उत्तर⇒ सोडियम तथा पोटैशियम तीव्र अभिक्रियाशील तत्त्व हैं। यह वायुमंडलीय ताप पर ही जल उठता है। अत: इसे खुले वायु में रखने से दुर्घटना की सम्भावना होती है। यही कारण है कि इसे किरोसीन तेल में डुबा कर रखा जाता है जिससे इसकी अभिक्रियाशीलता बिलकुल कम हो जाती है और यह वायमंडलीय ताप से अप्रभावित रहता है।
19.आयनिक यौगिकों के गलनांक उच्च क्यों होते हैं ?
उत्तर⇒ आयनिक यौगिक ठोस अवस्था में पाए जाते हैं। इनमें अंतर आण्विक आकर्षण बल काफी मजबूत होते हैं। अतः अंतर आण्विक आकर्षण को तोड़ने के लिए अधिक ऊर्जा की आवश्यकता होती है। यही कारण है कि आयनिक यौगिकों के गलनांक काफी उच्च होते हैं।
20. द्विधर्मी ऑक्साइड क्या है? उदाहरण दें।
उत्तर⇒ वैसे ऑक्साइड को द्विधर्मी अथवा उभयधर्मी ऑक्साइड कहे जाते हैं जिनमें अम्लीय और क्षारीय दानों गुण मौजूद होते हैं। जैसे एलुमिनियम ऑक्साइड। ये अम्लों और क्षारों से अभिक्रिया कर भिन्न-भिन्न यौगिकों का निर्माण करता है।
Al2O3 + 6HCI → 2AICI3 + 3H2O
Al2O3 + 2NaOH → 2NaAIO2 + H2O
21. कैरेट सोना का क्या अर्थ है ?
उत्तर⇒ शुद्ध सोने को 24 कैरेट कहते हैं। यह काफी नर्म होता है। इससे आभूषण बनाना कठिन है। आजकल गहने बनाने के लिए 22 कैरेट सोने की आवश्यकता होती है। 22 कैरेट सोना थोड़ा कठोर होता है। इसमें 22 भाग शुद्ध सोना और 2 भाग ताँबा या चाँदी मिला रहता है।
22. चाँदी, सोना एवं प्लैटिनम का उपयोग आभूषण बनाने में किया जाता है। क्यों ?
उत्तर⇒ सोना एक कोमल, सुनहले रंग का कीमती धातु है। इसका मुख्य उपयोग आभूषण बनाने में होता है। सोने की शुद्धता को कैरेट (Carat) में मापते हैं। शुद्ध सोना 24 कैरेट का होता है। आभूषण बनाते समय शुद्ध सोने में कम कीमती धात् ताँबा या चाँदी थोडा मिला दिया जाता है, जिससे वह कुछ कठोर बन जाता है। सोने के बने आभूषण 22 कैरेट के होते हैं। इसका अर्थ यह हुआ कि इन आभूषणों में 22 भाग सोना 2 भाग ताँबा या चाँदी की मिलावट है। 24 कैरेट सोना को 18 कैरेट सोना में बदलने के लिए 18 भाग सोना में 6 भाग ताँबा या चाँदी मिश्रित कर देते हैं। इस प्रकार चाँदी तथा प्लैटिनम का उपयोग किया जाता है
23. ध्वानिक (सोनोरस) किसे कहते हैं ?
उत्तर⇒ जब धातुएँ किसी कठोर सतह से टकराती है तो उनसे एक विशेष प्रकार की ध्वनि उत्पन्न होती है। इसे धातुई ध्वनि कहते हैं। इस प्रकार की धातुएँ ध्वानिक कहलाती हैं। स्कूल की घंटी से निकलने वाली ध्वनि इसका उदाहरण है।
24. एक्वारेजिया से क्या समझते हैं? इसके क्या उपयोग हैं ?
उत्तर⇒ एक्वारेजिया 3 : 1 के अनुपात में सांद्र हाइड्रोक्लोरिक अम्ल एवं सांद्र नाइट्रिक अम्ल का ताजा मिश्रण होता है। यह गोल्ड को गला सकता है। जबकि दोनों अम्लों में से प्रत्येक की यह क्षमता नहीं है। एक्वारेजिया भभकता द्रव होने के साथ प्रबल संक्षारक है। यह उन अभिकर्मकों में से एक है जो गोल्ड तथा प्लैटिनम को भी आसानी से गला सकता है।
25. थर्मिट अभिक्रिया क्या है?
उत्तर⇒ आयरन (III) ऑवसाइड ( Fe2O3 ) के साथ एल्युमीनियम की अभिक्रिया काफी तीव्र होती है और काफी ऊष्मा निकलता है इसका उपयोग रेल की पटरियों को जोड़ने में होता है। इस अभिक्रिया को थर्मिट अभिक्रिया कहते हैं।
26. अयस्कों के समृद्धीकरण से क्या तात्पर्य है ?
उत्तर⇒ पृथ्वी से निकलने वाले अयस्कों में मिट्टी, रेत आदि जैसी कई अशुद्धिया हटाना अयस्कों का समृद्धीकरण कहा जाता है।
27. लोहे को जंग से बचाने के दो उपाय बताइए।
उत्तर⇒ लोहे पर जंग लगने से बचाने के लिए लोहे की वस्तुओं पर पेंट करके, तेल लगाकर, ग्रीज लगाकर, यशद लेपन, क्रोमियम लेपन, एनोडीकरण या मिश्रधातु बनाकर आदि उपाय किए जाते हैं। इससे लोहे का संक्षारण रूक जाता है और लाह की वस्तुएँ बर्बाद होने से बच जाती है।
28. कॉपर को वायु में खुला छोड़ने पर वह हरे रंग का हो जाता है। क्यों ?
उत्तर⇒ कॉपर वायु में उपस्थित आर्द्र कार्बन डाइऑक्साइड के साथ अभिक्रिया करता है। जिससे इसकी सतह से भूरे रंग की चमक धीरे-धीरे खत्म हो जाती है तथा इस पर हरे रंग की चमक चढ़ जाती है। यह हरा पदार्थ कॉपर कार्बोनेट होता है।
29. हवाई जहाजों का ढाँचा ऐलुमिनियम के मिश्र धातुओं से क्यों बनाया जाता है ? वर्णन करें।
उत्तर⇒ हवाई जहाज का ढाँचा ऐलुमिनियम के मिश्र धातुओं डुरेलिमिन और मैग्लिनियम से निम्नलिखित कारणों से बनाया जाता है –
(i) ये अति हल्की मिश्र धातु है जिसका आपेक्षिक घनत्व बहुत कम है।
(ii) सुचालक होने के कारण विद्युत् प्रेषण तारें इनसे बनाई जा सकती हैं।
(iii) इन पर जंग नहीं लगता।
(iv) इन मिश्र धातुओं की कठोरता बहुत अधिक होती है।
(v) ये रसायनों के प्रति बहुत क्रियाशील नहीं है।
30. सल्फाइड अयस्क के सांद्रण के लिए फेन-उत्प्लावन विधि का संक्षेप में वर्णन करें।
उत्तर⇒ सल्फाइड अयस्कों का सांद्रण करने के लिए उन्हें खूब महीन पीसकर पाइन के तेल मिले जल के साथ मिलाकर हवा के झोके के द्वारा झाग पैदा किया जाता है। शुद्ध अयस्क झाग के साथ ऊपर आ जाता है तथा अशुद्धियाँ नीचे बैट जाती हैं। यह विधि फेन उत्प्लावन विधि कहलाती है।
31. सोडियम को केरोसीन तेल में डुबोकर क्यों रखा जाता है?
उत्तर⇒ सोडियम सक्रिय धातु है जो वायु में उपस्थित ऑक्सीजन से क्रिया करके सोडियम ऑक्साइड बनाती है। यह पानी से क्रिया कर सोडियम हाइड्रोक्साइड तथा हाइड्रोजन उत्पन्न करती है। वायु में खुला छोड़ देने पर यह आग पकड़ लेती है। इसलिए इसे मिट्टी के तेल में डुबोकर सुरक्षित रखते हैं।
32. वल्कनीकरण किसे कहते हैं ? इस प्रक्रिया में रबड़ में क्या परिवर्तन आते हैं ?
उत्तर⇒ सल्फर को प्राकृतिक रबड़ के साथ मिश्रित करने की प्रक्रिया को वल्कनीकरण कहते हैं। जब प्राकृतिक रबड़ को सल्फर से मिलाकर गर्म करते हैं तो रबड़ अधिक कठोर तथा कम लचकदार हो जाता है। रबड़ एक बहुलक है जिसमें एक ही तल में अणुओं की एक लंबी श्रृंखला होती है जिसके कारण रबड़ को खींचा जा सकता है परंतु सल्फर मिलाने से उसका लचीलापन समाप्त हो जाता है क्योंकि सल्फर रबड़ की श्रृंखला के समान अणुओं के मध्य आड़े बंध बनाता है। सल्फर कार्बन परमाणुओं के घूर्णन में भी बाधा डालती है।
33. खनिज और अयस्क क्या हैं ? लोहे के दो अयस्कों के नाम उनके आणविक सूत्र के साथ लिखें ।
उत्तर⇒ खनिज : ऐसे प्राकृतिक पदार्थ जिनमें धातुएँ अपने यौगिकों के रूप में होती हैं, खनिज कहलाते हैं। जैसे-फैल्सपार, अभ्रक आदि।
अयस्क : इन खनिजों को जिनसे लाभप्रद ढंग से धातुओं का निष्कर्षण किया जाता है, अयस्क कहलाते हैं। जैसे-हेमेटाइट, बॉक्साइट आदि।
लोहे के दो मुख्य अयस्क के नाम एक आण्विक सूत्र निम्नलिखित है-
(i) हेमाटाइट Fe2O3 एवं
(ii) आयरन पाइराइट FeS2
34. विद्यत अपघटनी शोधन से आप क्या समझते हैं ?
उत्तर⇒ कॉपर, जिंक, टिन, निकेल, चाँदी, सोना आदि जैसे अनेक धातुओं का शोधन विद्युत् अपघटन द्वारा किया जाता है । इस प्रक्रिया में अशुद्ध धातु को ऐनोड तथा शुद्ध धातु की पतली परत को कैथोड बनाया जाता है । धातु के लवण विलयन का उपयोग विद्युत्-अपघट्य के रूप में होता है। विद्युत-अपघट्य में जब धारा प्रवाहित होती है तब एनोड पर स्थित शुद्ध धातु विद्युत्-अपघट्य में घुल जाता है । इतनी ही मात्रा में शद्ध धात विद्यत-अपघटय से कैथोड पर निक्षेपित हो जाता है। विलयशील अशुद्धियाँ विलयन में चली जाती हैं तथा अविलयशील अशुद्धियाँ ऐनोड के नीचे निक्षेपित हो जाती हैं जिसे ऐनोड अवपंक कहते हैं।
35. Alloys स्टील क्या है ? किन्हीं तीन Alloy स्टील के नाम और उनकी संरचना लिखें।
उत्तर⇒ लोहे के साथ अन्य धातुओं और अधातुओं को मिलाकर प्राप्त की जाने वाली मिश्रधात स्टील कहलाती है।
इसके तीन प्रकार हैं-
(i) कार्बन स्टील- लोहे और कार्बन का मिश्र धातु कार्बन स्टील कहलाता है जिसमें कार्बन की मात्रा 0.5% से 1.5% तक होती है। कार्बन के अतिरिक्त सिलिकॉन, गन्धक, फॉस्फोरस तथा मैंगनीज भी होती है। कार्बन स्टील पेच, कील, गाड़ी की पटरियाँ, गार्डर तथा मशीनें बनाने में काम आता है । समुद्री जहाज, इमारतें तथा वाहन भी इसी से बनते हैं।
(ii) स्टेनलेस स्टील- जिसमें क्रोमियम, निकल, ताँबा, टंगस्टन या वेनडेनियम को मिलाया जाता है उसे स्टेनलेस स्टील कहते हैं। इसमें क्रोमियम 18% तथा निकल 8% होता है । यह डेयरी उद्योग अस्पतालों तथा बर्तन तैयार करने में काम आता है।
36. धातुकर्म क्या है ? इसके विभिन्न चरणों को लिखें।
उत्तर⇒ धातुकर्म वह विधि है जिसके द्वारा अयस्क से शुद्ध धातु का निष्कर्षण होता है।
अयस्क से शुद्ध धातु का निष्कर्षण कई चरणों में होता है –
(a) अयस्कों का समद्धीकरण- अयस्कों से गैंग को हटाने की प्रक्रिया को समृद्धीकरण कहते हैं।
(b) धातुओं का निष्कर्षण- इसके लिए निस्तापन, भर्जन, अपघटन आदि विधि का प्रयोग होता है।
(c) धातुओं का परिष्करण- अशुद्ध धातुओं को विभिन्न विधियों, जैसे विद्युत अपघटनी परिष्करण द्वारा शुद्ध किया जाता है।
37. एक मिश्रधातु क्या है ? मैग्नेलियम नामक मिश्रधातु के अवयवों के नाम लिखिए। इसके कोई दो उपयोग दीजिए।
उत्तर⇒ यह दो या दो से अधिक धातुओं अथवा तथा अधातु का संभागी मिश्रण है। उदाहरण—पीतल, तांबा तथा जिंक की मिश्रधातु है, कांसा, ताँबा तथा टिन की मिश्रधातु है।
मैग्नेलियम का संघटन-
ऐलुमिनियम (AI)-95%
मैग्नीशियम (Mg)-5%
मैग्नेलियम के उपयोग-
(i) हल्की तथा कठोर होने के कारण यह हवाई जहाज के भाग बनाने में प्रयोग की जाती है।
(ii) यह वाहनों तथा तुलाओं के भाग बनाने में काम आती है।
38. ऐलुमिनियम के उपयोग बताएँ।
उत्तर⇒ ऐलुमिनियम के उपयोग-
(i) ऐलुमिनियम हल्की धातु होने के कारण, हवाई जहाजों की बॉडी और मोटर इंजन बनाने के काम आती है।
(ii) यह बर्तन, फोटोफ्रेम तथा घरेलू उपयोग की ओर अनेक वस्तुएँ बनाने में काम आती है।
(iii) यह बिजली का सुचालक है, इसलिए आजकल बिजली के स्थानांतरण के लिए इनका प्रयोग किया जाता है।
(iv) ऐलमिनियम की बारीक परतों को खाने का सामान, दवाइयाँ दूध की बोतलें आदि पैक करने में प्रयुक्त की जाती हैं।
(v) ऐलुमिनियम पाउडर सिल्वर पेंट बनाने के काम आता है।
(vi) ऐलुमिनियम पाउडर एलूमिनोथिरैपी में प्रयुक्त होता है। यह प्रक्रम लोहे की पटरियों तथा मशीनों के टूटे भागों को जोड़ने के काम आता है।
39. अयस्क और खनिज में अंतर लिखिए।
उत्तर⇒ खनिज-धातुओं के प्राकृत यौगिक रूप को खनिज कहते हैं । अधिकांश धातुएँ हमें यौगिकों के रूप में ही प्राप्त होती हैं, जैसे-ताँबा हमें पाइराइट या क्यूपराइट से प्राप्त होता है। अयस्क-जिन पदार्थों (खनिजों) से धातु का निष्कर्षण सरल हो उन्हें अयस्क कहते हैं, जैसे- ऐलुमिनियम का अयस्क बॉक्साइट है तो लोहे का हैमेटाइट।